효과·부작용 논란 지속…FDA, 최종 승인 연말 결정 예정
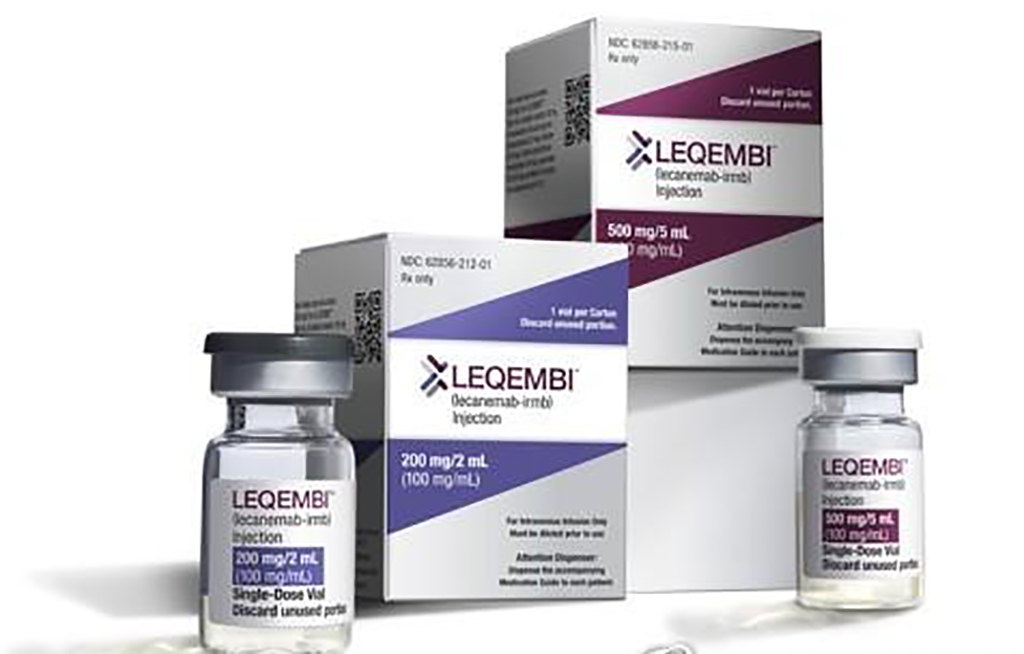
미국 식품의약국(FDA)이 알츠하이머 초기 환자의 기억력·사고력 저하를 늦춰주는 신약 ‘레카네맙'(상표명 레켐비)을 승인했다고 AP 통신이 6일 보도했다.
FDA는 신약 최종 승인에 앞서 초기 임상시험 결과를 토대로 제한적 사용을 허가하는 신속승인 절차를 통해 레카네맙을 가벼운 증상의 초기 알츠하이머 환자에게 사용할 수 있도록 허가했다.
레카네맙은 일본 에자이와 미국 바이오젠이 함께 개발한 신약으로, 알츠하이머 발병 메커니즘을 목적으로 한 신약으로는 처음으로 기억력과 사고력 저하를 늦추는 효과를 신빙성 있게 입증했다고 AP통신이 전했다.
레카네맙은 알츠하이머 주요 지표 중 하나인 아밀로이드라는 끈끈한 뇌단백질을 제거하는 방식으로 작동한다. 알츠하이머를 일으키는 물질이 정확히 무엇인지 밝혀지지 않았고 아밀로이드를 표적으로 한 치료제가 실패를 거듭해왔으나 연구자들은 아밀로이드를 포함한 복합적 치료법이 필요하다고 보고 있다.
그러나 레카네맙의 효과에 대해서는 논란의 여지가 있다는 주장이 나온다.
FDA의 이번 승인은 독립적인 생활이 가능하거나 약간의 도움만 필요한 알츠하이머 초기 환자 800명을 대상으로 한 임상 시험 결과를 토대로 이뤄졌다. 또 에자이는 이후 1천800명을 대상으로 한 임상시험 결과를 추가로 제출해 FDA가 올해 연말로 예상되는 최종 승인을 위해 검토 중이다.
임상시험에서 의사들이 알츠하이머 초기 환자들의 기억력과 판단력 등을 직접 인터뷰 등을 통해 18점 척도로 평가한 결과, 레카네맙을 18개월간 투여받은 환자들은 점수 하락 폭이 투여받지 않은 사람들보다 0.5점 정도 작은 것으로 나타났다. 연구팀은 이는 기억력과 판단력 등 저하가 5개월 정도 늦춰지는 효과로 볼 수 있다고 밝혔다.
워싱턴대 신경학자 조이 스나이더 박사는 “레카네맙은 치료제가 아니다. 이 약이 질병 진행을 멈추게는 못하지만, 속도는 상당히 늦춰준다”며 “이는 환자가 6개월~1년 더 운전을 할 수도 있음을 뜻한다”고 말했다.
그러나 밴더빌트대 신경학자 매튜 슈래크 박사는 “이 약의 효과는 진짜 미미하다. 임상적으로 유의미한 수준에 약간 못 미치는 것 같다”며 “대부분 환자는 효과를 인지하지 못할 것”이라고 말했다. 그는 의미 있는 개선을 위해서는 18점 척도에서 최소 1점은 개선돼야 한다고 덧붙였다.
레카네맙의 부작용도 우려되는 부분이다. 워싱턴대 스나이더 박사는 레카네맙은 한 달에 2번 주사를 맞아야 하는 불편과 함께 뇌부종과 가벼운 뇌출혈 등 부작용을 포함한 부정적인 측면이 있다고 지적했다. 또 FDA는 임상시험에서 혈액 응고 방지제 복용자 2명이 숨진 것과 관련해 의사들에게 혈액 응고 방제제를 복용하는 환자에게 레카네맙을 처방할 때는 주의하라고 경고했다.
레카네맙이 FDA의 최종 승인을 받더라도 알츠하이머 환자들이 얼마나 이용할 수 있을지는 미지수다. 레카네맙이 널리 사용되려면 효과와 부작용 논란이 해소되고 레카네맙 가격정책, 65세 이상 노인 공공건강보험인 메디케어(Medicare) 및 민간보험 적용 문제 등이 해결돼야 하기 때문이다.
에자이와 바이오젠은 2021년 레카네맘과 비슷한 신약인 ‘애듀헬름'(Aduhelm)의 FDA 승인을 받았으나 이 약에 대한 메디케어 적용이 크게 제한되면서 미국 시장 판매가 어렵게 되자 마케팅 계획을 포기한 바 있다.
FDA는 신약 최종 승인에 앞서 초기 임상시험 결과를 토대로 제한적 사용을 허가하는 신속승인 절차를 통해 레카네맙을 가벼운 증상의 초기 알츠하이머 환자에게 사용할 수 있도록 허가했다.
레카네맙은 일본 에자이와 미국 바이오젠이 함께 개발한 신약으로, 알츠하이머 발병 메커니즘을 목적으로 한 신약으로는 처음으로 기억력과 사고력 저하를 늦추는 효과를 신빙성 있게 입증했다고 AP통신이 전했다.
레카네맙은 알츠하이머 주요 지표 중 하나인 아밀로이드라는 끈끈한 뇌단백질을 제거하는 방식으로 작동한다. 알츠하이머를 일으키는 물질이 정확히 무엇인지 밝혀지지 않았고 아밀로이드를 표적으로 한 치료제가 실패를 거듭해왔으나 연구자들은 아밀로이드를 포함한 복합적 치료법이 필요하다고 보고 있다.
그러나 레카네맙의 효과에 대해서는 논란의 여지가 있다는 주장이 나온다.
FDA의 이번 승인은 독립적인 생활이 가능하거나 약간의 도움만 필요한 알츠하이머 초기 환자 800명을 대상으로 한 임상 시험 결과를 토대로 이뤄졌다. 또 에자이는 이후 1천800명을 대상으로 한 임상시험 결과를 추가로 제출해 FDA가 올해 연말로 예상되는 최종 승인을 위해 검토 중이다.
임상시험에서 의사들이 알츠하이머 초기 환자들의 기억력과 판단력 등을 직접 인터뷰 등을 통해 18점 척도로 평가한 결과, 레카네맙을 18개월간 투여받은 환자들은 점수 하락 폭이 투여받지 않은 사람들보다 0.5점 정도 작은 것으로 나타났다. 연구팀은 이는 기억력과 판단력 등 저하가 5개월 정도 늦춰지는 효과로 볼 수 있다고 밝혔다.
워싱턴대 신경학자 조이 스나이더 박사는 “레카네맙은 치료제가 아니다. 이 약이 질병 진행을 멈추게는 못하지만, 속도는 상당히 늦춰준다”며 “이는 환자가 6개월~1년 더 운전을 할 수도 있음을 뜻한다”고 말했다.
그러나 밴더빌트대 신경학자 매튜 슈래크 박사는 “이 약의 효과는 진짜 미미하다. 임상적으로 유의미한 수준에 약간 못 미치는 것 같다”며 “대부분 환자는 효과를 인지하지 못할 것”이라고 말했다. 그는 의미 있는 개선을 위해서는 18점 척도에서 최소 1점은 개선돼야 한다고 덧붙였다.
레카네맙의 부작용도 우려되는 부분이다. 워싱턴대 스나이더 박사는 레카네맙은 한 달에 2번 주사를 맞아야 하는 불편과 함께 뇌부종과 가벼운 뇌출혈 등 부작용을 포함한 부정적인 측면이 있다고 지적했다. 또 FDA는 임상시험에서 혈액 응고 방지제 복용자 2명이 숨진 것과 관련해 의사들에게 혈액 응고 방제제를 복용하는 환자에게 레카네맙을 처방할 때는 주의하라고 경고했다.
레카네맙이 FDA의 최종 승인을 받더라도 알츠하이머 환자들이 얼마나 이용할 수 있을지는 미지수다. 레카네맙이 널리 사용되려면 효과와 부작용 논란이 해소되고 레카네맙 가격정책, 65세 이상 노인 공공건강보험인 메디케어(Medicare) 및 민간보험 적용 문제 등이 해결돼야 하기 때문이다.
에자이와 바이오젠은 2021년 레카네맘과 비슷한 신약인 ‘애듀헬름'(Aduhelm)의 FDA 승인을 받았으나 이 약에 대한 메디케어 적용이 크게 제한되면서 미국 시장 판매가 어렵게 되자 마케팅 계획을 포기한 바 있다.
Bay News Lab / 저작권자 (c) 연합뉴스, 무단 전재–재배포 금지